На урок хімії заходити за посиланням :https://meet.google.com/eso-ryvf-nwn
Урок 29.05.2023 -9Б, 31.05 -9А
Тема: Повторення. Розчини.
Пригадайте базові поняття (усно) :
- розчин
- розчинена речовина та розчинник
- розчинення
- електроліти, неелектроліти
- електролітична дисоціація
- ступінь дисоціації
- реакції йонного обміну
- йонні рівняння
Пригадайте за схемою!
Пройдіть ТЕСТ
- розчин
- розчинена речовина та розчинник
- розчинення
- електроліти, неелектроліти
- електролітична дисоціація
- ступінь дисоціації
- реакції йонного обміну
- йонні рівняння
Урок 17.05.2023 -9Б, 18.05 -9А
Тема: Навчальний проект
Зробіть проект на тему"Видатні вітчизняні хіміки як учені й особистості" ( 2-3 вчених)
Презентацію проекту ( доповідь) надішліть:
Урок 15.05.2023 -9Б, 17.05 -9А
Тема : Хімічна наука і виробництво в Україні
Подивіться відео
Пройдіть тест
Урок 08.05.2023 -9Б, 04.05 -9А
Тема: Контрольна робота №2 з теми "Оксигеновмісні органічні сполуки"
Виконайте завдання контрольної роботи , пишіть на повійних листках, здайте на перевірку у середу, 10 травня( термін здачі для 9Б)
Для тих , хто не в селищі, надішліть роботу мені на електронну пошту чи у вайбер) ! ! ! tur.inna.volodumurivna@gmail.com
Урок 03.05.2023 -9Б, 10.05 -9А
Тема: Місце хімії серед наук про природу, її значення для розуміння наукової картини світу
Перегляньте відеоОпрацюйте параграф 37.Дайте письмові відповіді на питання №270, 271, 273( с.216)
або таке завдання : назвіть конкретні продукти хімічної галузі України, що використовуються в сільському господарстві та побуті
Урок 01.05.2023 -9Б, 03.05 -9А
Тема: Багатоманітність речовин та хімічних реакцій.Взаємозв`язки між речовинами та їх взаємоперетворення.
Перегляньте відеоурок 1 та відеоурок 2 Виконайте завдання письмово: 1) №2602) З поданими вихідними речовинами cкладіть та запишіть рівняння реакцій реакцій сполучення , розкладу, заміщення , обміну:MgO, Cu(OH)2 , H2O , HCl, Ca
Для зразка:Типи реакцій за числом вихідних речовини та кінцевих продуктів
Сполучення
A + В → С
N2 + 3H2 = 2NH3
Розкладу
А → В + С
Zn(OH)2 = ZnO + H2O
Заміщення
АВ + С → АС + В
Zn+2HBr= ZnBr2 + H2
Обміну
АВ + СД → АД + СВ
HBr+KOH=KBr+ H2O
Пройдіть тестування(термін - до 05.05, час - 40 хвилин)
Типи реакцій за числом вихідних речовини та кінцевих продуктів | Сполучення | A + В → С | N2 + 3H2 = 2NH3 |
Розкладу | А → В + С | Zn(OH)2 = ZnO + H2O | |
Заміщення | АВ + С → АС + В | Zn+2HBr= ZnBr2 + H2 | |
Обміну | АВ + СД → АД + СВ | HBr+KOH=KBr+ H2O | |
Урок 24.04.2023 -9Б, 26.04-9А
Тема:Практична робота №5 "Виявлення органічних сполук у харчових продуктах"Мета:виявити органічні продукти в харчових продуктах; формувати вміння самостійно виконувати досліди за поясненням у інструкції, виконувати досліди з дотриманням правил техніки безпеки Дослід 1.Виявлення крохмалю у харчових продуктах та фруктахЗа допомогою якісної реакції на крохмаль визнач вміст крохмалю в продуктах( варена картопля, рисова крупа, яблуко, лимон, борошно пшеничне, кетчуп, майонез, варена ковбаса).Посиніння спиртового розчину йоду свідчить, що крохмаль єДослід 2.Виявлення глюкози у фруктах.
Подивись відео "Визначення глюкози у виноградному сокові"
Дослід 3.Виявлення жиру в насінинах рослин.
Роздави горіх , насіння соняшника на аркуші паперу. Жирний слід на папері доводить присутність жиру.
Дослід 4.Виявлення органічних кислот у щавелевому, томатному, лимонному соку та йогурті. При додаванні натрій гідрогенкарбонату( харчової соди) виділяється вуглекислий заз
Роботу оформити згідно інструкції.
Подивись відео "Визначення глюкози у виноградному сокові"
Роздави горіх , насіння соняшника на аркуші паперу. Жирний слід на папері доводить присутність жиру.
Дослід 4.Виявлення органічних кислот у щавелевому, томатному, лимонному соку та йогурті. При додаванні натрій гідрогенкарбонату( харчової соди) виділяється вуглекислий заз
Роботу оформити згідно інструкції.
Урок 19.04.2023 -9Б, 20.04-9А
Тема: Значення природних і синтетичних органічних сполук.Захист довкілля від стійких органічних забруднювачів
1.Вивчіть за відеопоясненням 2.Запишіть задачу на початку відео( скільки риби, м'яса, сиру треба вживати для забезпечення добової потреби в білку)3.Розв'яжіть самостійно : Обчисліть масу 0, 25 моль стійкого органічного забруднювача, молекула якого містить 14 атомів Карбону, 8 атомів Гідрогену, 4 атоми ОксигенуДомашнє завдання: зробити проект "Друге життя паперу"
Урок 17.04.2023 -9Б, 19.04-9А
Тема: Поняття про амінокислоти.Білки як біополімери, їх роль1.Матеріал, викладений в презентації, опрацюй слайди 1-30 2.Випиши в конспекти визначення, фізичні та хімічні властивості, застосування амінокислот, структури білкових молекул.
3Подивись відеодослід "Біуретова реакція": https://www.youtube.com/watch?v=7fl-IJM25Zcта дослід 2 "Денатурація білків" : https://www.youtube.com/watch?v=Lto5n91xT9o
4.Задача .Обчисли масову частку Нітрогену в амінокислоті Гліцин( до 8 балів).Задача .Яку масу аміноетанової кислоти можна добути з 2 моль хлоретанової кислоти. Рівняння реакції дивись в презентації ( слайд 8).(10 - 12 балів)
Урок 05.04.2023 -9Б, 06.04.-9А
Тема: Крохмаль і целюлоза - природні полімери. Якісна реакція на крохмаль.
1.Опрацюйте новий матеріал, запишіть в зошит порівняльну харатеристику крохмалю і целюлози( порівняльна таблиця)
2.Зробіть досліди
Лабораторний дослід 1.Відношення крохмалю до води (розчинність, утворення клейстеру).
У склянку насипте трохи крохмалю, добавте холодної води. Розмішайте суміш, дайте їй відстоятися. Що спостерігається? Чи розчинився крохмаль у холодній воді?Закип'ятіть воду у склянці. Вилийте суміш із пробірки, перемішуючи, у гарячу воду. Що спостерігається? Зробіть висновок про відношення крохмалю до води.Збережіть крохмальний клейстер для наступного досліду.
Лабораторний дослід 2. Взаємодія крохмалю з йодом.До заздалегідь приготовленого крохмального клейстеру додайте краплину спиртового розчину йоду. Спостерігайте появу синього забарвлення.
3.Виконайте завдання:
3.1. Обчисліть, яка маса глюкози утвориться в результаті фотосинтезу, якщо рослини виділяють при цьому 224 л кисню( н.у.)
3.2. Якщо утворена глюкоза ( взяти результат задачі 3.1.) буде картоплею перетворена на крохмаль, то яка маса його утвориться? Ось рівняння до задачі
4.Домашнє завдання: опрацювати параграф 25 ; №185
1.Опрацюйте новий матеріал, запишіть в зошит порівняльну харатеристику крохмалю і целюлози( порівняльна таблиця)
2.Зробіть досліди
Лабораторний дослід 1.Відношення крохмалю до води (розчинність, утворення клейстеру).
У склянку насипте трохи крохмалю, добавте холодної води. Розмішайте суміш, дайте їй відстоятися. Що спостерігається? Чи розчинився крохмаль у холодній воді?Закип'ятіть воду у склянці. Вилийте суміш із пробірки, перемішуючи, у гарячу воду. Що спостерігається? Зробіть висновок про відношення крохмалю до води.Збережіть крохмальний клейстер для наступного досліду.
Урок 03.04.2023 -9Б, 05.04.-9А
Тема : Вуглеводи.Глюкоза, сахароза:молекулярні формули, фізичні властивості, поширення і утворення в природі. Якісна реакція на глюкозу.
1.Перегляньте відео ( клікніть) 2.Зробіть короткий конспект.Запишіть класифікацію вуглеводів (з картинки)
3.Пройдіть тестування .Обчислення до тесту виконуйте в зошиті.Зверніть увагу на класифікацію!!!
Урок 15.03.2023 -9Б, 16.02.-9А
Тема: Жири.Склад жирів , фізичні та хімічні властивості.Біологічна роль
1.Презентація (клікніть)
2. Обчисліть : 1) молярну масу тристеарину ; 2) масу триолеїну кількістю речовини 3 моль.Підказка : масу m обчислити як добуток молярної маси M на кількість речовини n
3.Переглятьте відео процесу миловаріння (за бажанням ):
Урок 13.03.2023 -9Б, 15.02.-9А
Тема: Вищі карбонові кислоти: стеаринова , пальмітинова, олеїнова.Мило, його мийна дія
Виконайте завдання (клікніть)Переглятьте відео "Порівняння мийної дії мила і синтетичних мийних засобів"
Учням, що за межами України, роботи надіслати на електронну пошту!
Тема: Вищі карбонові кислоти: стеаринова , пальмітинова, олеїнова.Мило, його мийна дія
Урок 02.02.-9А
Тема: Етанова (оцтова ) кислота)
Тема: Етанова (оцтова ) кислота)
Відео
Конспект
Розрахуйте масу 80% розчину оцтової кислоти та води потрібно взяти , щоб виготовити 500 г 6% розчину оцтової кислоти .
Урок 01.03.2023 -9Б, 01.02.-9А
Тема: Отруйність метанолу й етанолу .Згубна дія алкоголю на організм людини
Тема: Отруйність метанолу й етанолу .Згубна дія алкоголю на організм людини
Пояснення теми
Самостійна робота .Писати в зошит
(Кожна правильна відповідь оцінюється в 1 бал)
Загальна формула насичених одноатомних спиртів:
а)С п Н 2п +2 О г) С2 Н5 ОН
б) С п Н2п+1 ОН в) С п Н2п-2
2. Функціональна група спиртів – це:
а) група атомів СООН б) група атомів ОН
в) група атомів СОН г) група атомів NО2
3. Ізомерія. не властива для одноатомних насичених спиртів:
а) будови карбонового ланцюга;
б) положення функціональної групи; в) просторова.
4. Біологічні властивості етанолу:
а) нетоксичний, б) наркотична речовина,
в) сильна отрута, г) снодійне.
5. Укажіть, які фізичні властивості характерні для етанолу:
а) в’язка рідина, б) добре розчиняється уводі.
в) має солодкий смак, г) має специфічний запах.
6. Укажіть якісний реактив на етанол:
а) калій перманганат, б) хромова суміш,
в) натрій, г) бромна вода.
7. Атоми яких хімічних елементів обов’язково присутні в усіх молекулах спиртів:
а) С, N, Н, б) С, О, Н, в) С, Н, Сl
8. Зі збільшенням вуглеводневого радикала розчинність спиртів у воді:
а) збільшується, б) зменшується, в) не змінюється, г) спочатку збільшується, а потім зменшується.
9. Найбільшу розчинність у воді має:
а) метанол, б) бензин, в) пропанол, г) бутанол.
10. Укажіть молекулярну формулу етанолу:
а) С3Н7ОН, б) С2Н5ОН, в) С2Н5СОН, г) СН3ОН
Урок 27.02.2023 -9Б, 23.02.-9А
Тема: Горіння спиртів.Якісна реакція на гліцерол.Застосування спиртів.
Тема: Горіння спиртів.Якісна реакція на гліцерол.Застосування спиртів.
Складіть опорний конспект, на онлайн уроці розв`язано три задачі
Домашнє завдання: Розв'язати задачі самостійно :1-Який об'єм кисню (н.у) витратиться на горіння 0,75 моль метанолу?2-Вивести формулу насиченого одноатомного спирту , що має відносну густину за гелієм 15. Підказка : М = D (He) * 4
Урок 22.02.2023 -9Б, 22.02.-9А
Тема: Поняття про насичені одноатомні спирти .Функціональна група спиртів
Пояснення теми .Презентація Виконайте завдання (30 хвилин )Домашнє завдання.1.
Урок 15.02.2023 -9Б, 16.02.-9А
Тема: Навчальний проект на тему : "Альтернативні джерела енергії"
Зробити проект на задану тему. 1. В проекті зазначити , чому питання переходу з традиційних (викопне паливо) на альтернативні види енергії так важливого сьогодні.2. Розкрити тему ( розповісти про переваги різних видів енергії(сонячної , вітрової ......), недоліки також вказати 3.Які джерела енергії вчені вважають найперспективнішими?Зробити висновок.Виконаний проект надіслати на електронну пошту :
tur.inna.volodumurivna@gmail.com
Урок 13.02.2023 -9Б, 15.02.-9А
Тема: Нафта.Склад і властивості нафти .продукти перегонки нафти , їх застосування
Перегляньте , це цікаво ! https://youtu.be/2E2xVKMvDbM
| Теорії походження нафти | Органічна – із решток вимерлих рослин і твари |
| Мінеральна – при формуванні Землі утворені карбіди взаємодіяли з парами води у глибинах планети з утворенням вуглеводнів |
Нафтопродукти і їх застосування
Основні процеси переробки нафти
1. Фракційна перегонка.
2. Крекінг (термічний, каталітичний, гідрокрекінг).
3. Риформінг (ароматизація вуглеводнів).
4. Піроліз.
Первинна переробка
Крекінг
| Термічний | Каталітичний | |
| Умови | t 470-550ºС і тиск 2-7МПа, проходить повільно | t 450-500ºС, атмосферний тиск, каталізатор-алюмосилікати, проходить швидко |
| Напрямок процесу | Розщеплення високомолекулярних молекул з утворенням вуглеводнів нерозгалуженої будови | Розщеплення високомолекулярних молекул, їх ізомеризація |
| Склад бензинів | Насичені і багато ненасичених вуглеводнів | Вуглеводні з розгалуженим карбоновим ланцюгом |
| Якість бензинів | Більша детонаційна стійкість, ніж бензину прямої перегонки. Ненасичені вуглеводні легко окиснюються і полімеризуються, тому менш стійкі при зберіганні | Більша детонаційна стійкість ніж у бензину термічного крекінгу. Бензин стійкий при зберіганні |
| Продукти | Автомобільний бензин, технічний вуглець, газоподібні вуглеводні | |
При каталітичному крекінгу мазут або гасову фракцію нафти нагрівають перегрітою парою і змішують з подрібненим алюмосилікатним каталізатором. Завдяки цьому процесу великі молекули вуглеводнів розщеплюються. Так одержують інші необхідні речовини.У промисловості широко здійснюють процес каталітичного риформінгу бензинів. При нагріванні нафтопродуктів за наявності платинового каталізатора відбувається перетворення парафінових і циклопарафінових вуглеводнів у ароматичні, внаслідок чого октанове число бензинів значно підвищується.При температурі 700ºС і вищій відбувається піроліз.У результаті піролізу нафти основними прдуктами реакції є насичені вуглеводні (етилен, ацетилен) й ароматичні – бензен, толуол та ін. Оскільки піроліз нафти – один з найважливіших способів добування ароматичних вуглеводнів, то його часто називають ароматизацією нафти.
Застосування нафтопродуктів
Чи ви колись замислювались над тим, яким було б ваше життя без нафти і нафтопродуктів? Наприклад, мастила, виготовлені з нафти, використовуються для змащування рухомих деталей в автомобілях, велосипедах, візках та інших механізмах. Мастила зменшують тертя і цим сповільнюють руйнування деталей. З нафти отримують пальне для літаків, автомобілів і систем опалення. Вона також широко застосовується у виробництві косметики, фарб, барвників, медикаментів, добрив та іншої продукції.- Паливні продукти – бензин, гас, мазут.
- Будівельні продукти – гудрон.
- Сировина для хімічної промисловості:
- етилен, пропілен – виробництво пластмас;
- бутадієн, ізобутилен – виробництво волокон, синтетичних каучуків;
- бензол, стирол, толуол – виробництво пластмас, синтетичних волокон, каучуків, вибухових речовин;
- парафін – виробництво мийних засобів, пластифікаторів, свічок.
- Сировина для мікробіологічного виробництва білка.
Лабораторний дослід № 1. Ознайомлення зі зразками нафтопродуктів.
Мета: дослідити фізичні властивості нафтопродуктів і встановити зв’язок між їхнім хімічним складом, фізичними властивостями та галузями застосування.
1. Заповнити таблицю:
Фракції Склад фракції t кипіння, °C Фізичні властивості Застосування Газова ... — — Паливо
Безбарвна рідина
Прозора жовтувата рідина
Безбарвна рідина
Жовтувата рідина Залишок після перегонки Рідина чорного кольору

- етилен, пропілен – виробництво пластмас;
- бутадієн, ізобутилен – виробництво волокон, синтетичних каучуків;
- бензол, стирол, толуол – виробництво пластмас, синтетичних волокон, каучуків, вибухових речовин;
- парафін – виробництво мийних засобів, пластифікаторів, свічок.
Фракції | Склад фракції | t кипіння, °C | Фізичні властивості | Застосування |
Газова | ... | — | — | Паливо |
Бензин | Безбарвна рідина | |||
Лігроїн | Прозора жовтувата рідина | |||
Гас | Безбарвна рідина | |||
Газойль | Жовтувата рідина | |||
Мазут | Залишок після перегонки | Рідина чорного кольору | ||

Урок 30.01.2023 -9Б, 01.02.-9А
3. Яка реакція є якісною на визначення ненасичених речовин? відповідь тут, кладіть рівняння до побаченого відео https://www.youtube.com/watch?v=emod1S1rIAk
Домашнє завдання : обчисліть масу 2 моль етену та 10 моль етину.
Урок 18.01.2023 -9Б, 19.01.-9А
Тема: Гомологи метану
1.Новий матеріал вивчіть за відео2. Дайте визначення понять: гомологія, гомологи, гомологічна різниця 3. Випишіть гомологічний ряд алканів з відео4.Зверніть увагу на написання структурних формул та спосіб розв'язання задач
Домашнє завдання : обчисліть масу 2 моль етану та 1,5 моль бутану.
Урок 16.01.2023 -9Б, 18.01.-9А
Тема: Вуглеводні. Метан
1.НОвий матеріал вивчіть за відеопоясненням2. Закріпити ваші знання допоможе матеріал презентації3. Перевірте знання , пройдіть тестуванняДомашнє завдання : зробіть короткий конспект за презентацією
Урок 21.12.2022 -9Б, 22.12.-9А
Тема : Вступ до органічної хімії .Поняття про органічні солуки
Пояснення в презентації
- в зошиті виконати завдання з презентації, вийде короткий конспект
Тестування
- в зошиті виконати завдання з презентації, вийде короткий конспект
Урок 19.12.2022 -9Б, 21.12.-9А
Тема : Контрольна робота з теми "Хімічні реакції"
Роботу виконувати на подвійному листку, всі розрахунки писати в робочому зошиті, результати вносити в тест.Уважно читайте завдання!!!
Урок 05.12.2022 -9Б, 07.12.-9А
Тема : Екзотермічні та ендотермічні реакції
1.Перегляньте та опишіть досліди з відео2. Зробіть повідомлення або презентацію на одну з тем:- "Ендотермічні реакції на службі людині"
- "Екзотермічні реакції в житті живих організмів"
Презентації можна надіслати на електронну пошту:tur.inna.volodumurivna@gmail.com
- "Ендотермічні реакції на службі людині"
- "Екзотермічні реакції в житті живих організмів"
Урок 23.11.2022 -9Б, 24.11.-9А
Тема : Окисно-відновні реакції.Складання рівнянь окисно-відновних реакцій методом електронного балансу
1.Пригадаємо, як обчислювати ступінь окиснення2.Як складати електронний баланс Запишіть приклади всіх трьох рівнянь окисно-відновних реакцій разом з електронним балансом в зошит3.Самостійно виконайте:
б)Випари ртуті дуже небезпечні для здоров'я. Для хімічної демеркуризації використовують розбавлений водний розчин калій перманганату, підкислений хлоридною кислотою:
KMnO4+HCl+Hg→HgCl2+MnO2+KCl+H2O.
Використовуючи метод електронного балансу, складіть хімічне рівняння окисно-відновної реакції, що відповідає цій схемі. У відповіді зазначте коефіцієнт біля формули сполуки, що є відновником.
б)Випари ртуті дуже небезпечні для здоров'я. Для хімічної демеркуризації використовують розбавлений водний розчин калій перманганату, підкислений хлоридною кислотою:
KMnO4+HCl+Hg→HgCl2+MnO2+KCl+H2O.
Використовуючи метод електронного балансу, складіть хімічне рівняння окисно-відновної реакції, що відповідає цій схемі. У відповіді зазначте коефіцієнт біля формули сполуки, що є відновником.
Урок 21.11.2022 -9Б, 23.11.-9А
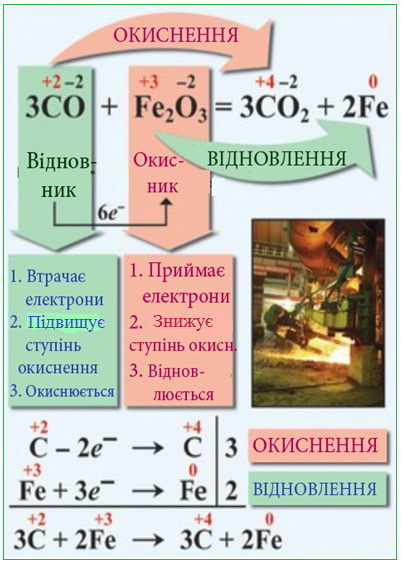
Тема : Окисно-відновні реакції.Процеси окиснення, відновлення, окисники та відновники
Матеріал в підручнику: параграфи 14,15Основні поняття: окисник, відновник, окиснення, відновлення.
Зміна ступеня окиснення елементу пов’язана зі зміною електронної структури частинок: віддачею або приєднанням електронів.
Процес віддачі електронів супроводжується підвищенням ступеня окиснення і називається окисненням.
Процес приєднання електронів супроводжується зниженням ступеня окиснення і називається відновленням.
Реакції, які супроводжуються зміною ступенів окиснення елементів називаються окисно-відновними . Під час цих реакцій відбуваються два протилежні процеси: окиснення і відновлення.
Частинки, які приєднують електрони – окисники ;
частинки, які віддають електрони – відновники . Таким чином, у цьому випадку має місце окисно-відновна рівновага.
Основні поняття: окисник, відновник, окиснення, відновлення.
Зміна ступеня окиснення елементу пов’язана зі зміною електронної структури частинок: віддачею або приєднанням електронів.
Процес віддачі електронів супроводжується підвищенням ступеня окиснення і називається окисненням.
Процес приєднання електронів супроводжується зниженням ступеня окиснення і називається відновленням.
Реакції, які супроводжуються зміною ступенів окиснення елементів називаються окисно-відновними . Під час цих реакцій відбуваються два протилежні процеси: окиснення і відновлення.
Частинки, які приєднують електрони – окисники ;
частинки, які віддають електрони – відновники . Таким чином, у цьому випадку має місце окисно-відновна рівновага.

Перевірте свої знання:
1.Який ступінь окиснення атома Оксигену в молекулі О2:
3.В якій ролі може виступати фтор у хімічних реакціях:
а)окисник; б) відновник
4.Позначте, що має статися з йоном Fe2+, щоб утворився йон Fe3+ :
6.Позначте заряд частинки, що утворюється при втраті атомом трьох електронів:
7.За схемою реакції Fe2O3 + CО → Fe + CO2 спочатку визначте ступені окиснення кожного елемента .
Для Феруму впишіть ступені окисненняFe +... ē= Fe - це процес.... (окиснення чи відновлення)Вкажіть на місці пропуску, скільки електронів він приєднавЙон Феруму - .....(відновник чи окисник)
Перевірте свої знання:
1.Який ступінь окиснення атома Оксигену в молекулі О2:
3.В якій ролі може виступати фтор у хімічних реакціях:
а)окисник; б) відновник
4.Позначте, що має статися з йоном Fe2+, щоб утворився йон Fe3+ :
6.Позначте заряд частинки, що утворюється при втраті атомом трьох електронів:
7.За схемою реакції Fe2O3 + CО → Fe + CO2 спочатку визначте ступені окиснення кожного елемента .
Урок 02.10.2022 -9Б, 03.11.-9А
Практична робота №2
Тема : Розв'язування експериментальних задач
Опишіть досліди за відео (клікнути)Хід роботиДослід 1 .Розпізнавання розчинів хлоридної кислоти, натрій гідроксиду та натрій хлориду.По краплі речовин з посудин 1.1, 1.2, 1.3 наносимо на універсальний індикаторний папір.Спостерігаємо:1.1- колір не змінився, це розчин...1.2.- колір..., це розчин...(назвіть речовину)1.3.- колір ...., розчин ... (назвіть речовину)Напишіть рівняння реакцій дисоціації всіх цих електролітів у водних розчинахВисновок: індикатором можна визначити нейтральне( натрій хлорид) , кисле , лужне середовищеДослід 2 .Розпізнавання розчинів натрій карбонату, натрій сульфату та натрій хлориду.
Реактиви для визначення: HCl (визначає карбонат-йон, даючи виділення безбарвного вуглекислого газу), Ba(NO3)2 (визначає сульфат- йони, утворюючи з ними білий осад)
А)У 2 чисті пробірки наливаємо по 2 мл розчину 2.1., випробовуємо його хлоридною кислотою.Спостерігаємо, що....Далі випробовуємо барій нітратом.Спостерігаємо...Оскільки ознак реакцій ми не бачили, робимо висновок - тут міститься розчин...Б)У 2 чисті пробірки наливаємо по 2 мл розчину 2.2., випробовуємо його хлоридною кислотою.Спостерігаємо, що змін немаєДалі випробовуємо барій нітратом.Спостерігаємо утворення... Отже тут міститься розчин - .......... ..........В)У 2 чисті пробірки наливаємо по 2 мл розчину 2.3., випробовуємо його хлоридною кислотою.Спостерігаємо .... ....Далі випробовуємо барій нітратом.Змін немає.Отже, тут міститься розчин - .......... ..........Напишіть два молекулярних рівняння реакцій між розчинами , що відбулися:Натрій карбонат + кислота=Натрій сульфат + барій нітрат=Складіть також рівняння цих реакцій у повній та скороченій йонній формах.Дослід 3.Здійснення перетворення :Mg ➡MgCl2➡MgCO3Послідовність дій описуєте самостійноСкласти рівняння реакцій:магній + ...= магній хлорид+...магній хлорид +....= магній карбонат+...Йонні рівняння тут писати не потрібноВисновок до практичної роботи: ...
Урок 31.10.2022 -9Б, 02.11.-9А
Тема: Виявлення в розчині гідроксид-йонів та йонів Гідрогену. Якісні реакції на деякі йони .Застосування якісних реакцій
1.Опишіть лабораторні досліди за відео
2.План опису дослідів :назва дослідупослідовність дійспостереження ( що змінилося під час якісної реакції)рівняння дисоціації або реакції в йонній формах Висновок: виявити ....йон в розчині можна за допомогою ...3.Для чого використовуються якісні реакії?(усно відповісти )
4.Пройдіть тестування (клікнути )
27.10 -9А
Тема: Практична робота 1."Реакції йонного обміну між електролітами у водних розчинах"
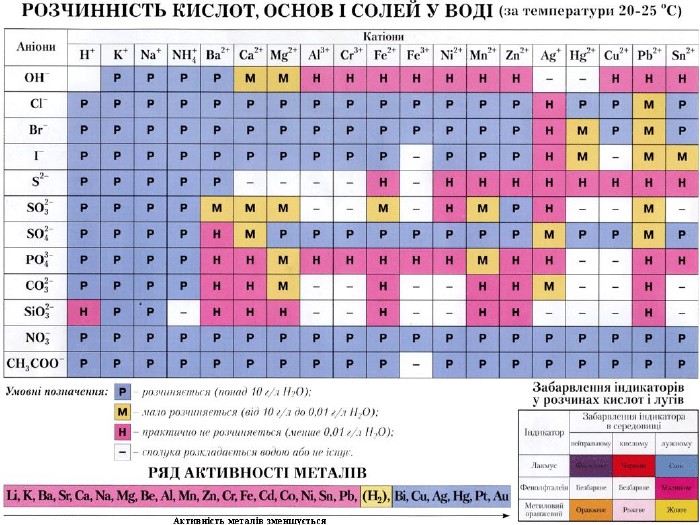
1.Пригадаємо умови перебігу реакцій йонного обміну:2.Використовуйте таблицю розчинності при складанні рівнянь реакцій у йонній формі( в кінці підручника) Хід роботи Дослід 1.Взаємодія розчину калій гідроксиду з розчином сульфатної кислоти кислоти( реакція нейтралізації)
Опишіть послідовність дій , спостереження та рівняння реакцій в молекулярній, повній йонній та скороченій йоннії формах.Реакція відбулася до кінця, тому що в результаті утворилася...
Дослід 2.Взаємодія розчину купрум (ІІ) сульфату з розчином натрій гідроксиду
Опишіть послідовність дій , спостереження та рівняння реакцій в молекулярній, повній йонній та скороченій йоннії формах. Реакція відбулася до кінця, тому що в результаті утворився...
Дослід 3 .Взаємодія розчину натрій карбонату з хлоридною кислотою
Опишіть послідовність дій , спостереження та рівняння реакцій в молекулярній, повній йонній та скороченій йоннії формах. Реакція відбулася до кінця, тому що в результаті виділився ... 4.Зробіть висновок
Урок 26.10.2022 -9Б, 28.10 -9А
Тема: Реакції йонного обміну між розчинами електролітів.Вправи на складання йонно- молекулярних рівнянь
- ферум(ІІ) хлоридом та натрій гідроксидом
- нітратною кислотою та барій гідроксидом
- хлоридною кислотою і калій карбонатом
Урок 19.10.2022 -9Б, 20.10 -9А
Тема: Реакції йонного обміну між розчинами електролітів, умови їх перебігу.Складання йонно- молекулярних рівнянь
1.Опрацюйте матеріал параграфа 112. вивчіть нову тему за презентацією, виконайте всі завдання з неї3.Домашнє завдання : параграф 11, № 82 (а, г)
Урок 17.10.2022 -9Б, 19.10 -9А
Тема: Поняття про рН розчину.Значення рН для характеристики кислотного чи лужного середовища
1.Пояснення нового матеріалу за презентацією (клікнути)2. Виконайте завдання презентації(зазначено , що писати в зошит )3 Тестовий контроль (клікнути )
Урок 12.10.2022 -9Б, 13.10 -9А
Тема: Ступінь електролітичної дисоціації.Сильні та слабкі електроліти
1.Пояснення нового матеріалу за відео:https://www.youtube.com/watch?v=fKeLdSJ7LWo2. Дайте визначення понять, використовуючи відео чи підручник. Ступінь дисоціації -це ...Ступінь ди соціації позначається ...Якщо ступінь дисоціації менший 3%, то електроліт є ...Приклади слабких основ та кислот...Електроліти, що дисоціюють повністю є ...Ступінь дисоціації залежить від таких чинників:...
3.Розв'яжіть :
3.1.Обчисліть ступінь дисоціації (%) електроліту, якщо з кожних 50 його молекул чотири розпалися на йони.
3.2. Укажіть кількість речовини (моль) катіонів, що утворилися внаслідок електролітичної дисоціації в розбавленому водному розчині натрій сульфату кількістю речовини 3 моль:
а) 2 ; б) 3 ; в) 6 ; г) 9. Розв'язок запишіть в зошиті.
3.3.
4.Творче завдання з відео( на 13 хв 48 сек)
Урок 10.10.2022 -9Б, 12.10 -9А
Тема: Електролітична дисоціація кислот , основ , солей у водних розчинах
1.Пояснення нового матеріалу за відео:https://www.youtube.com/watch?v=Xb_js5aoKno2. Дайте визначення понять, використовуючи відео чи параграф 7 підручника Кислоти -це електроліти, що дисоціюють на ...Основи - це електроліти, ...Солі -...3. Приклади рівнянь дисоціації з відео запишіть в зошит4.Самостійна робота.Нипишіть рівняння дисоціації розчинів електролітів:ферум (ІІІ) сульфату, стронцій гідроксиду , калій ортофосфату, натрій карбонату, сульфітної кислоти, сульфатної кислоти, сульфідної кислоти, калій гідроксиду.
Домашнє завдання : параграф 7, №50
Урок 03.10.2022 - 9Б, 05.10- 9А
Тема: Розв`язування розрахункових задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини
1.Повторити за підручником параграф 4
2.Виконання інтерактивних вправ:
2.
3. Розв’язування задач
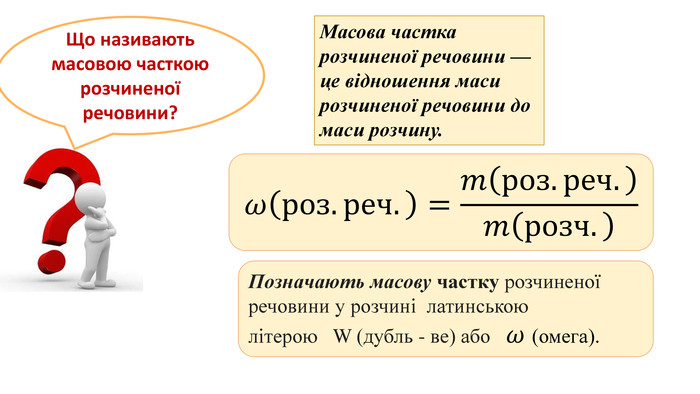
Опорні формули:
ω (р.р.) =
ω (%) (р.р.) – масова частка розчиненої речовини
Задача 1. Пишемо в зошит
Обчислити масову частку цукру в розчині, приготовленому при розчиненні 20 г цукру в 180 г води.
Дано: Розв’язання: m (р.р.)=20 г 1.Знайдемо масу розчинуm (розчину) = m (р.р.) + m (Н2О) m(розчину)= 20+180 =200 г 2.Записуємо формулу для обчислення масової частки ω(%) (р.р.) - ?
Відповідь: масова частка цукру 10%
Задача 2.Пишемо в зошит
Визначити масу та об’єм води, в якій потрібно розчинити 10 г солі, щоб утворився 25%-ний її розчин.
Дано: Розв’язання: m (р.р.)=10 г 1. Записуємо формулу для обчислення масової частки m(Н2О) - ?
Відповідь: маса води становить 30г , об’єм – 30 мл
Задача 3( подібна до 2.)Пишемо в зошит, самостійно розв`язати
Визначити масу та об’єм води , в якій потрібно розчинити 25 г цукру, щоб утворився 10%-ний її розчин.
Задача 4 (високий рівень )
Алгоритм розв’язання задачі
Дано: | Розв’язання: |
m (р.р.)=20 г m(Н2О)=180г | 1.Знайдемо масу розчину m (розчину) = m (р.р.) + m (Н2О) m(розчину)= 20+180 =200 г 2.Записуємо формулу для обчислення масової частки ω (%) (р.р.)=m(р.р.):m(розчину)=20:200=0,1 2. Знаходимо масову частку у відсотках: ω (%) (р.р.)=0,1•100%=10% |
ω(%) (р.р.) - ? | |
Відповідь: масова частка цукру 10% | |
Дано: | Розв’язання: |
m (р.р.)=10 г ω (солі) = 25%=0,25 | 1. Записуємо формулу для обчислення масової частки ω (р.р.)=m(р.р.):m(розчину) маса води - х г m (роз)= m (р.р.) + m (Н2О)=10+ х г 2. Підставляємо значення: 0,25 =10г : (10+x) 0,25(10 + х) = 10 2,5 + 0,25х = 10 0,25 х = 10-2,5 0,25 х = 7,5 х =7,5: 0,25=30 г – це m (Н2О) 3. Знаходимо об’єм води: V = m (води)/ ρ (води ρ (Н2О) = 1 г/мл V = 30 г: 1 г/мл=30 мл |
m(Н2О) - ? | |
Відповідь: маса води становить | |
4. Обчислити кількість моль водню
Оскільки за рівнянням реакції
n(кислоти): n(водню)=1 : 1
тому n(кислоти)= n(водню)
5. Запишіть відповідь
Задача для домашньої роботи( подібна до 1 в класній роботі): Обчислити масову частку лимонної кислоти в розчині, приготовленому при розчиненні 10г кислоти в 190 г води.
Урок 26.05.2022
Тема: Повторення. Органічні сполуки - вуглеводні
1.Згадайте класифікацію вуглеводнів
2.Згадайте гомологічний ряд алканів
3.Згадайте номенклатуру( назви )
4.Пройдіть ТЕСТ ( не пізніше 26.05)
Урок 19.05.
Тема: Взаємозв`язки між речовинами та їх взаємоперетворення. Типи хімічних реакцій
Перегляньте відеоурок1 та відеоурок2 Виконайте завдання письмово: 1) №2602) З поданими вихідними речовинами cкладіть та запишіть рівняння реакцій реакцій сполучення , розкладу, заміщення , обміну:MgO, Cu(OH)2 , H2O , HCl, CaПройдіть тестування (термін - до 20.05, час - 30 хвилин)
Урок 16.05.
Тема: Навчальний проект
Зробіть проект на тему"Видатні вітчизняні хіміки як учені й особистості"
Презентацію проекту ( доповідь) надішліть:
tur.inna.volodumurivna@gmail.com
Урок 12.05.2022
Тема : Хімічна наука і виробництво в Україні
Подивіться відео
Пройдіть тест
Урок 12.05.2022
Тема: Місце хімії серед наук про природу, її значення для розуміння наукової картини світу
Опрацюйте параграф 37.Дайте письмові відповіді на питання №270-273( с.216)
Урок 05.05.2022
Тема: Роль хімічної науки для забезпечення сталого розвитку людства
1.Опрацюйте матеріал презентації
2.Пройдіть тест , напишіть в зошиті розв`язок до задачі тесту та надішліть на Viber(хто за кордоном)
Урок 28.04.2022
Тема: Контрольна робота №2 з теми "Оксигеновмісні органічні сполуки"
Виконайте завдання контрольної роботи , пишіть на повійних листках, здайте на перевірку.Для тих , хто не в селищі, надішліть роботу мені на електронну пошту чи у вайбер) ! ! ! tur.inna.volodumurivna@gmail.com
Урок 25.04.2022
Тема: Навчальний проект
Зробіть проект на одну з тем:
- Дослідження хімічного складу їжі
- Хімічний склад жувальних гумок
- Хімічний склад засобів догляду за ротовою порожниною
Презентацію проекту чи доповідь надішліть:
tur.inna.volodumurivna@gmail.com
Тема: Практична робота №4 "Властивості етанової кислоти "
Робимо віртуальну практичну роботу:https://www.youtube.com/watch?v=_4TnpwnmCFEОформіть роботу у вигляді таблиці (назва досліду, рівняння реакції , спостереження і висновок- тобто три колонки, як було на відео).В кінці роботи написати висновок
- Зошити здати у п`ятницю 25.03
- Зошити здати у п`ятницю 25.03
Урок 17.03.2022
Тема: Хімічні властивості етанової кислоти
Опрацюйте матеріал за посиланням:https://www.youtube.com/watch?v=3udZyOYk-jsСкладіть опорний конспект за планом:
- Дія оцтової кислоти на індикатори.Дисоціація
- Взаємодія з металом( цинком, магнієм)
- Взаємодія з оксидом металу ( купрум оксидом)
- Взаємодія з основами( реакція нейтралізації)
- Взаємодія з солями слабших кислот
- Естерифікація ( взаємодія зі спиртами)
- Заповнити таблицю ( на відео 14хв 30 сек)
Тестування (клікнути)
Домашнє завдання: Який об'єм газу (н.у.) що виділиться при взаємодії 20% розчину натрій гідрогенкарбонату NaHCO3 масою 84 г з етановою кислотою?
- Дія оцтової кислоти на індикатори.Дисоціація
- Взаємодія з металом( цинком, магнієм)
- Взаємодія з оксидом металу ( купрум оксидом)
- Взаємодія з основами( реакція нейтралізації)
- Взаємодія з солями слабших кислот
- Естерифікація ( взаємодія зі спиртами)
- Заповнити таблицю ( на відео 14хв 30 сек)
Домашнє завдання:
Урок 14.03.2022
Тема: Етанова (оцтова) кислота
Опрацюйте матеріал за відеопоясненнямСкладіть опорний конспект за планом:
- Що таке карбонові кислоти? Де поширені в природі?
- Хто і коли відкрив винну кислоту?
- Що таке карбоксильна група? Складіть формулу етанової кислоти і обведіть карбоксильну групу
- Опишіть фізичні властивості етанової кислоти
- В чому небезпека концентрованих розчинів оцтової кислоти?
- Де люди застосовують оцтову кислоту?
Домашнє завдання: Обчислити масу води, яку слід додати до 20 г льодяної оцтової кислоти ( 100%), щоб отримати 500 г 3% водного розчину оцтової кислоти( задача на розчини, тому рівняння реакції не пишемо)




















Немає коментарів:
Дописати коментар