2022-2023
На онлайн-урок з хімії заходити за посиланням:
https://meet.google.com/srt-sjqt-sui
2022-2023
Урок 21.12.2023
Тема: Молярна маса
1.Опрацюйте відео https://www.youtube.com/watch?v=4xj3iASI0d02. Опрацюйте параграф 23; виконайте завдання № 4,6 (с.124)
Урок 29.05.2023 -8А , 30.05 - 8А
Тема: Повторення.Кількість речовини.
Розрахунки за формулами
1.Повторіть тему за своїм конспектом2. Пройдіть тестування (виконати не пізніше 25.05)
Урок 16.05.2023 -8А , 19.05 - 8А
Тема. Повторення .Розв`язування задач і вправ .
Опрацюйте зразки розв'язування Зразок 1. Скласти формулу солі та знайти суму індексів:а) калій сульфіту ( розв'язано нижче) б)алюміній ортофосфату
Зразок 2.Яка кількість речовини калій сульфіду масою 11 г.
Зразок 3.а)При реакції сполучення Li2O з N2O5 утворилась сіль.Запиши рівняння реакції, назви сіль.Порахуйте суму коефіцієнтів.б) при реакції обміну між CuO та HBr утворилася сіль і вода.Назвіть сіль. Склади рівняння. Порахуйте суму коефіцієнтів.Дивіться розв`язки.
Зробіть самостійно( дивіться в таблицю розчинності !)Завдання 1.Скласти формулу солі та знайти суму індексів:а) алюміній броміду б) ферум (ІІІ) нітрату.Завдання 2.Яка кількість речовини барій нітрату масою 10,44 г.Завдання 3.При реакції обміну К2O з хлоридною кислотою утворилась сіль та вода.Запишіть рівняння реакції, назвіть сільПорахуйте суму коефіцієнтів.
Урок 15.05.2023 -8А , 16.05 - 8А
Тема: Повторення.Будова атома. Періодичний закон та
система хімічних елементів Д.І.Менделєєва
1.Подивіться відео та пригадайте матеріал , що вивчали в І семестрі
2. Пройдіть тест( до 17.05, час обмежено до 30 хвилин)
Урок 09.05.2023 -8А , 09.05 - 8Б
Тема: Контрольна робота з теми "Основні класи неорганічних сполук"
Урок 05.05.2023 -8А, 08.05- 8Б
Тема: Неорганічні сполуки, довкілля і людина
Опрацюйте матеріал параграфа 39
Дайте відповіді на питання:1.Чому стічні води , що містять луги, не такі шкідливі, як кислоти?2.Що таке смог ? Причини його появи?Які сполуки в його складі?3.Які гази зумовлюють парниковий ефект? Які наслідки цього ?4.Які з оксидів утворюють кислотні опади?5.Які мінеральні добрива, що внесено в грунт у надмірній кількості, спичиняють "цвітіння водойм?6.За допомогою крейди ( кальцій карбонату) можна нейтралізувати стічні води, що містять :а) сульфатну кислоту;б) нітрати;в) натрій гідроксидПисати відповіді в робочий зошит
Урок 02.05 -8А , 02.05 -8Б
Тема: Добування оксидів, основ , кислот, солей
1. Працюємо разом на онлайн -уроці за презентацією
2.Завдання , які ми встигнемо, розберемо на уроці
3.Подібні буде задано на домашню роботу:..- додому завдання 1, 4, 7б) з презентації .. - додому завдання 2, 5 (скласти рівняння 1- 17 ОКРІМ 10) , задача 11 з презентації
Урок 01.05.2023 -8Б
Тема: Практична робота №3. Розв`язування експериментальних задач з теми "Основні класи неорганічних сполук"
1. Пригадайте, які речовини можна розпізнати індикаторами?2.Як кислота змінює колір індикатора лакмусу ?3.За таблицею розчинності подивись, чи є розчинними солі барій хлорид та натрій сульфат?
Досліди на розпізнавання :
1. сульфатної кислоти ( російською серная кислота)2. натрій сульфату;3. барій хлориду
Подивися відеоексперимент
Практичну роботу писати на подвійному листку та оформити за інструкцією(клікнути)
Урок 21.04 -8А , 18.04 -8Б
Тема:Генетичні зв`язки між основними класами неорганічних сполук
1.Перегляньте відео
2.Запишіть як зразок генетичний ряд металу та рівняння реакцій згідно цієї схеми перетворень 3.Запишіть генетичний ряд металу , що не утворює луг, а утворює нерозчинну основу( в даному випадку Fe(OH)2 ) з рівняннями :
4.Запишіть генетичний ряд неметалу з рівняннями :5.Застосуйте свої знання під час тестування (на проходження тесту відведено 40 хвилин)
Урок 18.04 -8А , 17.04 -8Б
Тема:Генетичні зв`язки між основними класами неорганічних сполук
1.Пригадайте класи неорганічних сполук за таблицею
2. Пригадайте відмінність між основними та кислотними оксидами:основні- оксиди металічних елементів, адже їм відповідають основи,кислотні - оксиди неметалічних елементів, їм відповідають кислоти
3.Вивчи та законспектуй нову тему, тобі допоможе відеопояснення. 4.Виконайnt завдання, що розміщено в кінці пояснення(генетичний зв`язок металу Феруму Fe або неметалу фосфору P).Fe➡FeO➡Fe(NO3)2➡Fe(OH)2
P→ P2O5→ H3PO4→ K3PO4
1.Пригадайте класи неорганічних сполук за таблицею
2. Пригадайте відмінність між основними та кислотними оксидами:
Складіть відповідні хімічні ріняння.
Урок 07.04 -8А , 04.04 -8Б
Тема:Хімічні властивості середніх солей
Пояснення за презентацією на онлайн-уроціЗавдання для самостійної роботи:
1.Складіть хімічні рівняння:Na2S+ HNO3 →...+...BaCO3+H2SO4→CuBr2+ LiOH→CuCl2+Al→PbCl2+Mg→
2.Домашнє завдання:а)При реакції сполучення BaO з SO3 утворилась сіль.Запишіть рівняння реакції, назвіть сільб) при реакції обміну між LiOH та H3PO4 утворилася сіль і вода. Назвіть сіль. Складіть рівняння. Порахуйте суму коефіцієнтів.
Урок 04.04 -8А , 03.04 -8Б
Тема: Солі. Складання формул солей. Фізичні властивості солей. Поширеність у природі.
Опрацюйте параграф 35
1. Запишіть визначення поняття "солі" (с.141)
2. Алгоритм складання формул солей (с.142): назви солей складаються з двох слів: перше – назва металу у називному відмінку, друге – назва кислотного залишку.
Як же самостійно скласти формулу солі?
Щоб зрозуміти, подивіться моє навчальне відео
3.Прочитайте про фізичні властивості солей (в підручнику с.192-193)
Для нас сіль з дитинства щось солоне.
Солоні солі – натрій хлорид, калій хлорид, натрій сульфат
(«глауберова сіль»), яка ще досі використовується як послаблюючий засіб.
Але є гіркі – магній сульфат. Її також використовують у медицині як
послаблюючий та заспокійливий засіб.
Є також і солодкі. Це, наприклад берилій хлорид.
Солі бувають розчинні у воді та нерозчинні.
Дивимось на таблицю розчинності речовин( в кінці підручника)
BaSO4 та CaCO3 (крейда) практично не розчиняються у воді.
BaSO4 використовують при рентгенівському обстеженні шлунка.
Для того, щоб повністю розчинити дрібку порошку кальцій карбонату та барій
сульфату знадобиться ціла цистерна води.
4.Випишіть з переліку лише солі(оксиди, кислоти, основи пропускати)
CaO, H3PO4, Na2SO4, K2O, BaCO3, H2SO4, Mg(NO3)2, P2O5, BaS, H2S, SO3, MgO, HCl, AlBr3, H2CO3 , Ca(OH)2, N2O3, Li2O, LiNO3, Ba(OH)2, Al2O3.
Назвіть ці солі. Розчинні вони чи нерозчинні?
5.Складіть формули солей за назвами:
а) алюміній сульфід
б) натрій сульфіт
в) кальцій метофосфат
г) літій карбонат
Домашнє завдання: параграф 35 , №1, 3 (с.196)
Задача на високий рівень:
При взаємодії кальцій оксиду з карбон (IV) оксидом масою 4,4 г утворилась сіль.
Склади рівняння реакції сполучення. Визнач масу утвореної солі
Урок 17.03 -8А , 14.03 -8Б
Тема: Хімічні властивості амфотерних гідроксидів
1. Працюємо разом над презентацію ( на онлайн- уроці)
2.Письмово в зошиті виконайте завдання:
- Дайте визначення , які сполуки є амфотерними ?
- Складіть 2 рівняння реакцій, що доводять амфотерність берилій гідроксиду( реакцію взаємодії з лугом КОН в розчині( за зразком с.203) та реакцію з хлоридною кислотою
- Виконати завдання з презентації при умові , якщо не встигнемо все виконати разом
- Домашнє завдання : параграф 37, № 2 (с.206)
- Дайте визначення , які сполуки є амфотерними ?
- Складіть 2 рівняння реакцій, що доводять амфотерність берилій гідроксиду( реакцію взаємодії з лугом КОН в розчині( за зразком с.203) та реакцію з хлоридною кислотою
- Виконати завдання з презентації при умові , якщо не встигнемо все виконати разом
- Домашнє завдання : параграф 37, № 2 (с.206)
Урок 14.03 -8А , 13.03 -8Б
Тема. Роз`язування задач .Розрахунки за хімічними рівняннями маси,об`єму, кількості речовин реагентів та продуктів реакції
Матеріал в підручнику § 29Завдання 1. Згрупуйте в три колонки :оксиди, основи, кислоти
Al(OH)3, Na2О, N2О5, HNО3, H2SО4, КОН
HCl, CaO, H3PО4, Mg(OH)2, NaOH, SО3
Fe(OH)3, K2О, Zn(OH)2, CО2, Ba(OH)2
2.Задачі (робите разом зі мною на онлайн уроці та записуєте в зошит ) 2.1. Обчислити об'єм водню , що виділиться при взаємодії 12 г магнію з розчином хлоридної кислоти
Al(OH)3, Na2О, N2О5, HNО3, H2SО4, КОН | |
HCl, CaO, H3PО4, Mg(OH)2, NaOH, SО3 | |
Fe(OH)3, K2О, Zn(OH)2, CО2, Ba(OH)2 |
2.2. Обчислити масу осаду, що утвориться при дії 8 г натрій гідроксиду на розчин алюміній хлориду
Урок 03.03 -8А
Тема :Хімічні властивості розчинних основ(лугів)
1. Опрацюйте відео:
та матеріал параграфу 31 до с.168(до Розкладання нерозчинних гідроксидів)
2.Письмово в зошиті виконайте завдання:
- Усно дайте визначення "реакція нейтралізації", "реакція обміну"
- Складіть рівняння реакцій взаємодії калій гідроксиду -
- з сульфідною кислотою та ортофосфатною кислотою
- з нікель (ІІ ) сульфатом
- з сульфур (VI) оксидом
- Завдання 3( с.171)
- Домашнє завдання : параграф 31, №1 усно, 5 письмово
- Усно дайте визначення "реакція нейтралізації", "реакція обміну"
- Складіть рівняння реакцій взаємодії калій гідроксиду -
- з сульфідною кислотою та ортофосфатною кислотою
- з нікель (ІІ ) сульфатом
- з сульфур (VI) оксидом
- Завдання 3( с.171)
- Домашнє завдання : параграф 31, №1 усно, 5 письмово
Урок 28.02 -8А , 28.02 -8Б
Тема :Фізичні властивості основ.Поширеність у природі та використання основ.Вплив на довкілля та здоров`я людини
1. Опрацюйте відео
2.Письмово в зошиті виконайте завдання:
- Дайте визначення основ, складіть формули за назвами: хром(ІІ) гідроксид, барій гідроксид, ферум( ІІІ) гідроксид, натрій гідроксид, лантан(ІІІ) гідроксид.Опиратися на с.140-141 та параграф 30 підручника)
- На які дві групи поділяють основи?
- Дайте визначення.Луги - це ... основи (Керуватися таблицею розчинності!)У завданні 1 є два луги, тож підкресліть їх формули
- В чому відмінність фізичних властивостей лугів та нерозчинних основ? Запишіть їх
- Де використовують кальцій, натрій гідроксиди?( можна усно)
- Пройдіть тест
- Домашнє завдання : параграф 30, №1 , 7
- Дайте визначення основ, складіть формули за назвами: хром(ІІ) гідроксид, барій гідроксид, ферум( ІІІ) гідроксид, натрій гідроксид, лантан(ІІІ) гідроксид.Опиратися на с.140-141 та параграф 30 підручника)
- На які дві групи поділяють основи?
- Дайте визначення.Луги - це ... основи (Керуватися таблицею розчинності!)У завданні 1 є два луги, тож підкресліть їх формули
- В чому відмінність фізичних властивостей лугів та нерозчинних основ? Запишіть їх
- Де використовують кальцій, натрій гідроксиди?( можна усно)
- Пройдіть тест
- Домашнє завдання : параграф 30, №1 , 7
Урок 24.02 -8А , 27.02 -8Б
Тема : Хімічні властивості кислот.Взаємодія кислот з основами та солями
Презентація для вивчення матеріалу1.Всі , хто не вийшов на онлайн урок , працюєте за підручником с177-180 (параграф 33)2.Виконайте завдання самостійно №2 ,3, 5а (с.181 підручника)
Урок 14.02.2023 - 8Б,17.02 -8А
Тема : Хімічні властивості кислот
1.Презентація містить пояснення та посилання на відеодосліди .
Урок 13.02.2023 - 8Б,14.02 -8А
Тема : Кислоти , їх склад , назви та класифікація кислот.Фізичні властивості кислот, їх поширеність в природі ,вплив на здоров'я та довкіллля
1. Відеопояснення :https://www.youtube.com/watch?v=u6rC3jJzg2w&t=19s
2.Виконайте завдання за документом
2.Виконайте завдання за документом
Урок 31.01.2023 - 8Б, 03.02 -8А
Тема : Фізичні властивості оксидів, їх поширеність в природі ,вплив на здоров'я та довкілля
1. Відеопояснення :https://www.youtube.com/watch?v=ypH4Yw9oDq4
2.Виконайте завдання за документом
Урок 30.01.2023 - 8Б, 31.01 -8А
Тема : Класифікація неорганічних сполук , їхній склад та номенклатура (назви)
1. Зверніть увагу , що єчотири класи неорганічних сполук : оксиди, основи , кислоти , солі
2.Запишіть таблицю в зошит
3.Виконайте завдання за цією таблицею
4. Вам у вайбер надіслано моє відеопояснення, як скласти формули оксидів, кислот, основ і солей.Тож назвіть речовини, які ви виписали із таблиці (завдання 3)
Завдання додому :опрацюйте параграф 26 підручника, №3,4, 7
Урок 17.01.2023 - 8Б, 20.01 -8А
Тема : Розв`язування задач з теми "Кількість речовини.Молярна маса.Молярний об`єм. Відносна густина газів"
1. Повторіть по записах в робочому зошиті, як обчислювати кількість речовини, масу за молярною масою, об`єм за н.у., відносну густину газів
Увага! Обчислення робіть в зошиті, буду перевіряти .Тест без обчислень не буде оцінюватись
Урок 16.01.2023 - 8Б, 17.01 -8А Тема :Відносна густина газів
1. За відео опрацюйте матеріал.Теорія 1-7 хвилини, а приклади розв`язування задач з 8,45 хвилини цього відео, на це зверніть увагу!Ви будете самостійно робити саме такі задачі 2.Письмово в зошиті розв`яжіть задачі:
а) обчисліть відносну густину за повітрям нітроген( І) оксиду;
б) обчисліть молярну масу невідомого газу Х, що має відносну густину за киснем 2 ;
в) за н.у. 2,8 г невідомого газу Х займає об`єм 2,24 л.Обчисліть відносну густину газу Х за воднем.
Урок 19.1
Урок 19.1
Урок 20.12.2022 - 8Б, 23.12 -8А
Урок 20.12.2022 - 8Б, 23.12 -8А
Тема: Обчислення молярної маси речовини за формулою та маси і кількості речовини
Виписати розв'язок 2,3,4 задач з відео у зошит , за таким зразком розв'яжіть самостійно:- Обчисліть масу крейди CaCO3 кількістю речовини 5 моль
- Яка кількість речовини барій сульфату BaSO4 масою 46,6 г ?
- Невідомий метал має масу 10 г і кількість речовини 0,25 моль.Визначте метал
- Обчисліть молярні маси речовин за формулами :
- (CuOH)2CO3
- FeCO3
- HNO3
- Cl2O7
- Ba(NO3)2
- Обчисліть масу крейди CaCO3 кількістю речовини 5 моль
- Яка кількість речовини барій сульфату BaSO4 масою 46,6 г ?
- Невідомий метал має масу 10 г і кількість речовини 0,25 моль.Визначте метал
- Обчисліть молярні маси речовин за формулами :
- (CuOH)2CO3
- FeCO3
- HNO3
- Cl2O7
- Ba(NO3)2
19.12.2022 - 8Б, 20.12 -8А
19.12.2022 - 8Б, 20.12 -8А
Тема: Молярна маса речовини
1. Відеопояснення та відео2- За підручником опрацювати параграф 23.
- Виписати формули с. 122.Вправу 4, 7 ( с. 124 ) розв'язати
- За підручником опрацювати параграф 23.
- Виписати формули с. 122.Вправу 4, 7 ( с. 124 ) розв'язати
Урок 06.12.2022 - 8Б, 09.12 -8А
Тема: Захист проектів
- Краса і користь кристалів
- Застосування кристалів у техніці
2.Якщо це презентація, надішліть на електроннну пошту: tur.inna.volodumurivna@gmail.comМожна також написати роботу в зошиті(обсягом не менше сторінки), здасте зошити , коли вийдемо на навчання в школу.
- Краса і користь кристалів
- Застосування кристалів у техніці
Урок 05.12.2022 - 8Б, 06.12 -8А
Практична робота №1
Тема: Дослідження фізичних властивостей речовин з різними типами кристалічних граток
1. Роботу пишете в робочому зошиті за відеоОформляєте у вигляді таблиці , як на відео
2.У параграфі 21 , на с.111 є матеріал, що пояснює залежність фізичних властивостей від типу гратки.Використовуйте його при написанні практичної роботи.
Урок 22.11.2022 - 8Б, 25.11 -8А
Тема :Йони.Йонний зв'язок , його утворення.
1. ВідеоЗапишіть в зошиті конспект за відео
2.Покажіть процес утворення йона Магнію, ОксигенуСкладіть схему утворення магній оксиду
3.Види йонів: катіони та аніони.Запишіть все це .
Урок 21.11.2022 - 8Б, 22.11 -8А
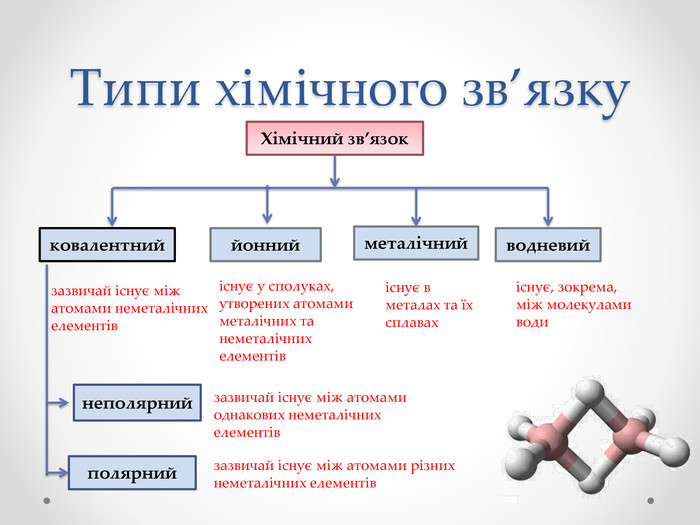
Тема :Ковалентний зв'язок , його утворення.Полярний і неполярний ковалентний зв'язок.Електронні формули молекул
Запишіть в зошиті або з відео, або з параграфів 18-19 визначення основних понять
2.Алгоритм складання схеми утворення ковалентного зв'язку ( на відео починається з 7:00 хвилини) .Для молекули азоту N2 , НF, O2, СО2 цю схему запишіть (використовуйте підручник с.92-93)3.Використовуючи схему "Типи хімічного зв'язку"
Завдання додому: №1, 3, 5 (с. 99 підручника)
Урок 18.11 -8А
Тема :Природа хімічного зв'язку .Електронегативність атомів хімічних елементів .Типи хімічного зв'язку
Парараф 17 підручника
Пояснення та завдання в презентації
Урок 31.10.2022 - 8Б, 01.11 -8А
Тема :Цікаві історичні факти з відкриття і походження назв хімічних елементів
1.Відео Запишіть в зошиті не менше 10 хімічних елементів ( звідки походить назва, хто і коли відкрив їх2.Які елементи відкрив Гемфрі Деві?3.Які елементи названо на честь учених?
Завдання додому:№6(с. 79 підручника) № 2(с.84)
Урок 24.10.2022 - 8Б, 25.10 -8А
Тема :Характеристика елемента за місцем в періодичній системі та будовою атома
Парараф 15(с.78 ) підручника
1.Навчальна презентація. (клікнути).Характеристику Нітрогену з презентації запишіть в зошит2.Дайте характеристику Берилію та Силіцію
Завдання додому:№2,3(с. 78 підручника)
Урок 18.10.2022 - 8Б, 21.10 -8А
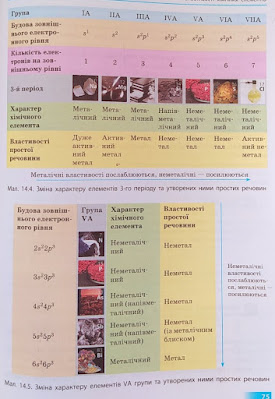
Тема :Залежність властивостей речовин від періодичної зміни будови атомів
1.Перегляньте матеріал с.75 (мал.14.4, 14.4.)2.3.Виконайте завдання: № 1, 3, 4 ( с.77)4.Після опрацювання матеріалу параграфа 13 виконайте завдання №3, 4 ( с.64)
Завдання додому:№5 або 7 (с. 77 підручника)
Урок 17.10.2022 - 8Б, 18.10 -8А
Тема :Періодична система хімічних елементів Д.І. Менделєєва , її структура
1.Перегляньте навчальне відео:https://www.youtube.com/watch?v=guQGEMS_X_E2.Дайте визначення"група" , "підгрупа", "період"3.Випишіть елементи IVа та IVв підгруп 4.Основні закономірності періодичної системи випишіть з відео4.Після опрацювання відео і параграфа 12 виконайте завдання №3, 4 ( с.64)Тестування ( клікнути ! пройти вчасно)Завдання додому:№6 (с. 64 підручника)
Урок 11.10.2022 - 8Б, 14.10 -8А
Тема :Періодичний закон Д.І.Менделєєва(сучасне формулювання)
1.Перегляньте навчальне відео:https://youtu.be/L5-ac3Q5gy4?t=832.Запишіть, як саме сформулював періодичний закон Д.І.Менделєєв.3.Запишіть сучасне формулювання закону .Підкресліть слова, що відрізяють обидва фомулювання.Менделєєв вважав головною відносну атому масу елемента, бо на той момент будова атома ще не була відкрита.Коли дізналися, що головною характеристикою є заряд ядра( на що вказує порядковий номер елемента), тоді з'явилося сучасне формулювання закону. 4.Після опрацювання відео і параграфа 11 дати письмові відповіді на питання 2-6( с.59)Завдання додому:№1 (с. 60 підручника)
Урок 10.10.2022 - 8Б, 11.10 -8А
Тема :Електронні та графічні електронні формули атімів хімічних елементів №1-20
1. З параграфа 10 випишіть розподіл електронів для Li,Не,C,O,Ne,Na,Ar, K
2. Робота з навчальним відео:https://www.youtube.com/watch?v=Gp6_39Zj6lg3.Розпишіть розподіл електронів по рівнях та підрівнях для атома елемента з порядковим номером 14 ,16, 174.Тестування: https://naurok.com.ua/test/join?gamecode=1938026Завдання додому:№6 (с. 54 підручника)
Урок 04.10. - 8Б, 07.10- 8А
Тема :Електронні орбіталі.енергетичні рівні та підрівні.
1. Дайте письмові відповіді.При цьому використовуйте таблицю Менделєєва.
а.Визначте кількість електронів, протонів, нейтронів у атомі Натрію, Фосфору
б.Визначте кількість електронних шарів у атомі Нітрогену і Гелію.Яким чином ви це визначили?в.До складу атома металу, в який упаковують шоколад входить 13 електронів.Визначте елемент.Скільки електронних шарів він має?
2. Робота з навчальним відео:https://www.youtube.com/watch?v=aNsKVGhSOyg3.Розпишіть розподіл електронів по рівнях та підрівнях для атома елемента з порядковим номером 5 (Бору)Завдання додому:Розпишіть розподіл електронів по рівнях та підрівнях для атома елемента з порядковим номером 9(Флуору)
б.Визначте кількість електронних шарів у атомі Нітрогену і Гелію.Яким чином ви це визначили?
Урок 03.10. - 8Б, 04.10- 8А
Тема : Стан електронів у атомі .Поняття про радіус атома
1. Дайте письмові відповіді.При цьому використовуйте таблицю Менделєєва.
а.Що таке нукліди? Запишіть нуклід Нітроген-15 та Оксиген- 18
б.Визначте кількість електронів у Нітрогену , Оксигену, Карбонув.До складу атома металу, що захищає живі організми від негативного впливу рентгенівських променів, входить 82 протони та стільки ж електронів.Назвіть метал.Визначте кількість нейтронів в його ядрі( від атомної маси відняти порядковий номер елемента)
2. Робота з навчальним відео:https://www.youtube.com/watch?v=dyXOWGvm-lc3.Дайте письмові відповіді на контрольні питання с.41 , попередньо опрацювавши параграф 8Завдання додому: мал 9.1. зі с.41 зобразіть в зошит ; з відео випишіть основні поняття
б.Визначте кількість електронів у Нітрогену , Оксигену, Карбону
2021-2022 н. р.
2021-2022 н. р.
23.05.2022Тема. Повторення . Розв`язування задач і вправ .
Зразок 1. Скласти формулу солі та знайти суму індексів:а) калій сульфіту ( розв'язано нижче) б)алюміній ортофосфату
Зразок 2.Яка кількість речовини калій сульфіду масою 11 г.
Зразок 3.а)При реакції сполучення Li2O з N2O5 утворилась сіль.Запиши рівняння реакції, назви сіль.Порахуйте суму коефіцієнтів.б) при реакції обміну між CuO та HBr утворилася сіль і вода.Назвіть сіль. Склади рівняння. Порахуйте суму коефіцієнтів.Дивіться розв`язки.
Зробіть самостійно.Завдання 1.Скласти формулу солі та знайти суму індексів:а) алюміній йодиду б) ферум (ІІІ) сульфату.Завдання 2.Яка кількість речовини барій нітрату масою 2,61 г.Завдання 3При реакції сполучення Na2O з водою утворилась основа.Запишіть рівняння реакції, назвіть основуПорахуйте суму коефіцієнтів.
Урок 18.05
Тема: Повторення.Будова атома. Періодичний закон та система хімічних елементів Д.І.Менделєєва
1. Повторіть тему за конспектом
2.Подивіться відео
3. Пройдіть тестування( до 20.05, час обмежено до 40 хвилин)
Урок 11.05.
Тема: Неорганічні сполуки, довкілля і людина
Опрацюйте матеріал параграфа 39
Дайте відповіді на питання:1.Чому стічні води , що містять луги, не такі шкідливі, як кислоти?2.Що таке смог ? Причини його появи?Які сполуки в його складі?3.Які гази зумовлюють парниковий ефект? Яку загрозу вони несуть ?4.Які з оксидів утворюють кислотні опади?5.Які мінеральні добрива, що внесено в грунт у надмірній кількості, спичиняють "цвітіння водойм?6.За допомогою крейди ( кальцій карбонату) можна нейтралізувати стічні води, що містять :а) сульфатну кислоту;б) нітрати;в) натрій гідроксидНадішліть роботи на перевірку у вайбер
Урок 04.05- 09.05
Тема: Добування оксидів, основ , кислот, солей
1. Працюємо разом з вами в Зумі за презентацією
2.Завдання , які ми встигнемо, розберемо на уроці
3.Подібні буде задано на домашню роботу:04.05- додому завдання 1, 4, 7б) з презентації 09.05 - додому завдання 2, 5 (скласти рівняння 1- 17 ОКРІМ 10) , задача 11 з презентації
Урок 27.04.2022
Тема: Практична робота №3. Розв`язування експериментальних задач з теми "Основні класи неорганічних сполук"
1. Пригадайте, які речовини можна розпізнати індикаторами?2.Як кислота змінює колір індикатора лакмусу ?3.За таблицею розчинності подивись, чи є розчинними солі барій хлорид та натрій сульфат?
Досліди на розпізнавання :
1. сульфатної кислоти ( російською серная кислота)2. натрій сульфату;3. барій хлориду
Подивися відеоексперимент
Практичну роботу оформити за інструкцією
Урок 25.04.2022
Тема: Захист проектів на тему:
- Неорганічні речовини- представники оксидів, основ, кислот, солей в будівництві та побуті
- Вплив нерганічних сполук на життя і здоров`я людини
- хімічний склад і використання мінералів
tur.inna.volodumurivna@gmail.com
Урок 20.04.2022
Тема: Практична робота № 2 з теми "Дослідження властивостей основних класів неорганічних сполук"
Роботу пишемо в зошиті за інструкцією (в таблиці пишете першу колонку, друга- роз'яснення для вас(її не пишете), у третій колонці даєте відповіді на питання другої)
Дослід 1. Взаємодія кислот з основними оксидами
Дослід 2. Взаємодія кислот із солями
Дослід 3. Взаємодія кислот з основами
Дослід 4. Взаємодія кислот з металами
Домашнє завдання. Повторити хімічні властивості класів неорганічних сполук.
Роботу можна надіслати , але бажано в п'ятницю принести зошит
Урок 18.04.2022
Тема:Генетичні зв`язки між основними класами неорганічних сполук
Урок 11.04.2022
Тема: Хімічні властивості властивості солей
1.Пригадайте властивості солей, розглянувши схему:2. Перегляньте відео лабораторного досліду №4."Взаємодія металів із солями водному розчині". Запишіть назву досліду, хід досліду, спостереження та рівняння реакцій:AgNO3+Cu=CuSO4+ Fe=Pb(NO3)2+Zn=
3.Перегляньте відео лабораторного досліду №5."Взаємодія солей з лугами у водному розчині". Запишіть назву досліду, хід досліду, спостереження та рівняння реакції
FeCl3+ KOH=
4.Перегляньте відео лабораторного досліду №6 "Реакція обміну між солями в розчині". Запишіть назву досліду, хід досліду, спостереження та рівняння реакції
CuSO4+ Na2S=
5.Зробіть висновок до лабораторних дослідів
Урок 06.04.2022
Тема: Хімічні властивості середніх солей
Тема: Солі. Складання формул солей. Фізичні властивості солей. Поширеність у природі.
Опрацюйте параграф 35
1. Запишіть визначення поняття "солі" (с.141)
2. Алгоритм складання формул солей (с.142): назви солей складаються з двох слів: перше – назва металу у називному відмінку, друге – назва кислотного залишку.
Як же самостійно скласти формулу солі?
Урок 30.03.2022
Тема : Самостійна робота з теми "Оксиди.Основи.Кислоти"
1. Повторіть по записах в робочому зошиті теми "Оксиди.Основи.Кислоти"та параграфи 28-34
2.Письмово в зошиті виконайте самостійну роботу
Увага! Пишіть в робочому зошиті, фотографуйте, надішліть на електронну пошту для перевірки(для тих , хто живе далеко) Хто живе недалеко, тим принести робочий зошит до п`ятниці 01.04 в школу (ящик Тур І.В.)
Cu(OH)2, Na2О, Р2О5, HNО3, Al2(SО4)2, КОН | |
Fe(OH)2, CaO, SО3, H3PО4, MgCl2, NaOH | |
Fe(OH)3, K2О, CО2, HCl, Zn3(PO4)2, Ba(OH)2 |
Пропоную клікнути на розв`язок
2.2. Яка кількість речовини натрій гідроксиду прореагує з карбон(IV) оксидом об`ємом 4,48 л(н.у.) з утворенням натрій карбонату та води.
Пропоную такий спосіб розв`язку
3. Зробіть задачу самостійно
При взаємодії натрій гідроксиду масою 4 г з сульфатною кислотою утворилася сіль натрій сульфат та вода. Яка маса кислоти прореагувала?
4.Домашнє завдання. Яка кількість речовини сульфур (ІV) оксиду SO2 (н.у.) вступить в реакцію з 0,5 моль натрій гідроксиду з утворенням натрій сульфіту та води?Очисліть об`єм SO2 за н.у.
Урок 23.03.2022
Тема : Хімічні властивості амфотерних гідроксидів
1. Опрацюйте відео , починаючи з 12хв. 58 с. та матеріал параграфу 37
2.Письмово в зошиті виконайте завдання:
- Дайте визначення , які сполуки є амфотерними ?
- Складіть 2 рівняння реакцій, що доводять амфотерність берилій гідроксиду( реакцію взаємодії з лугом КОН в розчині( за зразком с.203) та рівняння реакції взаємодії з хлоридною кислотою
- Запишіть опорну схему , що в кінці відео
- Домашнє завдання : параграф 37, № 2 (с.206)
- Дайте визначення , які сполуки є амфотерними ?
- Складіть 2 рівняння реакцій, що доводять амфотерність берилій гідроксиду( реакцію взаємодії з лугом КОН в розчині( за зразком с.203) та рівняння реакції взаємодії з хлоридною кислотою
- Запишіть опорну схему , що в кінці відео
- Домашнє завдання : параграф 37, № 2 (с.206)
Урок 21.03.2022
Тема : Хімічні властивості нерозчинних основ
Конференція в Zoom об 11.25
1. Опрацюйте презентацію та матеріал параграфу 31
2.Письмово в зошиті виконайте завдання:
- Розв' яжіть задачу №1 з презентації
- Запишіть опорну схему з 14 слайду
- Розв' яжіть задачу №1 з презентації
- Запишіть опорну схему з 14 слайду
Домашнє завдання : параграф 31, №8, 9 , 13 (с.171)
Урок 16.03.2022
Тема :Хімічні властивості розчинних основ(лугів)
Конференція в Zoom о 10.20
1. Опрацюйте відео:
та матеріал параграфу 31 до с.168(до Розкладання нерозчинних гідроксидів)
2.Письмово в зошиті виконайте завдання:
- Усно дайте визначення "реакція нейтралізації", "реакція обміну"
- Складіть рівняння реакцій взаємодії калій гідроксиду -
- з сульфідною кислотою та ортофосфатною кислотою
- з нікель (ІІ ) сульфатом
- з сульфур (VI) оксидом
- Завдання 3( с.171)
- Домашнє завдання : параграф 31, №1 усно, 5 письмово
- Усно дайте визначення "реакція нейтралізації", "реакція обміну"
- Складіть рівняння реакцій взаємодії калій гідроксиду -
- з сульфідною кислотою та ортофосфатною кислотою
- з нікель (ІІ ) сульфатом
- з сульфур (VI) оксидом
- Завдання 3( с.171)
- Домашнє завдання : параграф 31, №1 усно, 5 письмово
Урок 14.03.2022
Тема :Фізичні власнивості основ.Поширеність у природі та використання основ..Вплив на довкілля та здоров`я людини
1. За матеріалами відеопояснення
2.Письмово в зошиті виконайте завдання:
- Дайте визначення основ, складіть формули за назвами: хром(ІІІ) гідроксид, барій гідроксид, ферум( ІІ) гідроксид, цезій гідроксид, лантан(ІІІ) гідроксид.Опиратися на с.140 підручника)
- На які дві групи поділяють основи?
- Дайте визначення.Луги - це ... основи (Керуватися таблицею розчинності!)У завданні 1 є два луги, то ж підкресліть їх формули
- В чому відмінність фізичних властивостей лугів та нерозчинних основ? Запишіть їх
- Де використовують кальцій, натрій гідроксиди?( можна усно)
- Пройдіть тестування
- Домашнє завдання : параграф 30, №1 , 3(а,в), 7
- Дайте визначення основ, складіть формули за назвами: хром(ІІІ) гідроксид, барій гідроксид, ферум( ІІ) гідроксид, цезій гідроксид, лантан(ІІІ) гідроксид.Опиратися на с.140 підручника)
- На які дві групи поділяють основи?
- Дайте визначення.Луги - це ... основи (Керуватися таблицею розчинності!)У завданні 1 є два луги, то ж підкресліть їх формули
- В чому відмінність фізичних властивостей лугів та нерозчинних основ? Запишіть їх
- Де використовують кальцій, натрій гідроксиди?( можна усно)
- Пройдіть тестування
- Домашнє завдання : параграф 30, №1 , 3(а,в), 7
Урок 14.04.2021
Тема: Хімічні властивості властивості солей
1.Пригадай властивості солей, розглянь схему2. Переглянь відео лабораторного досліду №4."Взаємодія металів із солями водному розчині". Запиши назву дослід, хід досліду, спостереження та рівняння реакцій:AgNO3+Cu=CuSO4+ Fe=Pb(NO3)2+Zn=
3.Переглянь відео лабораторного досліду №5."Взаємодія солей з лугами у водному розчині". Запиши назву дослід, хід досліду, спостереження та рівняння реакції
FeCl3+ KOH=
4.Переглянь відео лабораторного досліду №6 "Реакція обміну між солями в розчині". Запиши назву дослід, хід досліду, спостереження та рівняння реакції
CuSO4+ Na2S=
5.Зроби висновок до лабораторних дослідів6.Домашнє завдання :параграф 32, №256
Урок 13.04.2021
Тема:Хімічні властивості середніх солейПояснення нового матеріалу в моїй лекції.Завдання для самостійної роботи:1.Складіть опорний конспект в зошиті 2.Складіть хімічні рівняння:BaCO3→...+...BaCO3+HNO3→CuBr2+ LiOH→CaCl2+AgNO3→MnCl2+Mg→Fe2(SO4)3+BaCl2→4.Домашнє завдання:а)При реакції сполучення BaO з SO3 утворилась сіль.Запишіть рівняння реакції, назвіть сіль.Порахуйте суму коефіцієнтів.б) при реакції обміну між LiOH та H3PO4 утворилася сіль і вода. Назвіть сіль. Склади рівняння. Порахуйте суму коефіцієнтів.
Урок 20.01.2021
Тема : Розв`язування задач з теми "Кількість речовини.Молярна маса.Молярний об`єм.Відносна густина газів"
1. Повторіть по записах в робочому зошиті, як обчислювати кількість речовини, масу за молярною масою, об`єм за н.у., відносну густину газів
Увага! Обчислення робіть в зошиті, надішліть на електронну пошту.Тест без обчислень не буде оцінюватись
Урок 22.10.2020
Тема :Значення періодичного закону. Життя та діяльність Д.І.Менделєєва
1.За презентацією опрацюйте матеріал
2.Письмово в зошиті виконайте завдання І та ІІ.
3.Надішліть на електронну пошту фотозвіт виконаної роботи
Урок 20.10.2020
Тема : Навчальний проект
1.Зробити проект на обрану тему:
Хімічні елементи в літературних творах
Цікаві історичні факти з відкриття і походження назв хімічних елементів
2.Оформити проект в зошиті чи у вигляді презентації на надіслати на електронну пошту
Хімічні елементи в літературних творах
Цікаві історичні факти з відкриття і походження назв хімічних елементів
Урок 15.10.2020
Тема : Характеристика хімічних елементів №1-20 за положенням в Періодичній системі та будовою атома
1.За планом , що записаний в зошиті, дайте характеристику елемента: №17.
Підказка: утворює кислотний оксид та кислоту
2.Розв`язуємо задачу разом і пишемо в зошит:
Визначте елемент, що знаходиться в Vа групі, відносна молекулярна маса його вищого оксиду становить 108.
Розв`язок: нехай Аr( E) = x , шукаємо вищий оксид в таблиці Vа -в цій групі внизу зазначено E2O5
Mr( E2O5) = Х* 2+ 16*5= 108
2х+80=108
2х=108-80=28
х=28:2
х= 14 ( за таблицею знаходимо, що це відносна атомна маса Нітрогену , Vа )
Відповідь: Нітроген
3. Розв`яжіть самостійно:Визначте елемент Іа групи, якщо відносна молекулярна маса вищого оксиду становить 94.
4 .Домашнє завдання : дати характеристику елемента №6
Урок 14( 13.05.- 8Б , 18.05.- 8 А)
Тема: Систематизація та коригування знань учнів
До задачі №9 тесту напишіть в зошиті рішення та вишліть


















Немає коментарів:
Дописати коментар